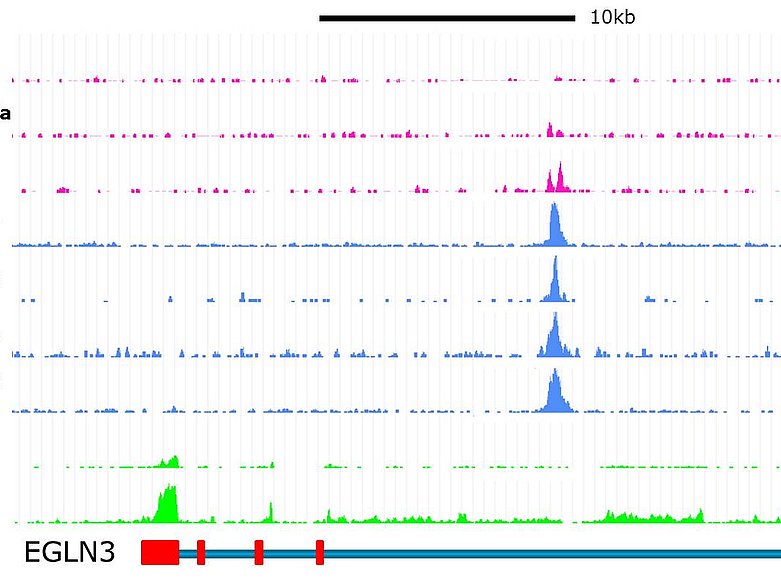
Sauerstoffmangel spielt eine wichtige Rolle bei vielen physiologischen und pathophysiologischen Prozessen. Dabei stehen die Hypoxie-induzierbaren Transkriptionsfaktoren (HIF) im Zentrum der hypoxischen Genregulation. Durch DNA-Bindung an Hypoxie-responsiven Elementen aktivieren sie Gene, die adaptive Prozesse in der Zelle und dem Organismus regulieren. Wichtige Beispiele direkter HIF-Zielgene sind z.B. Erythropoetin, VEGFA, Cyclin D1 oder glykolytische Enzyme.
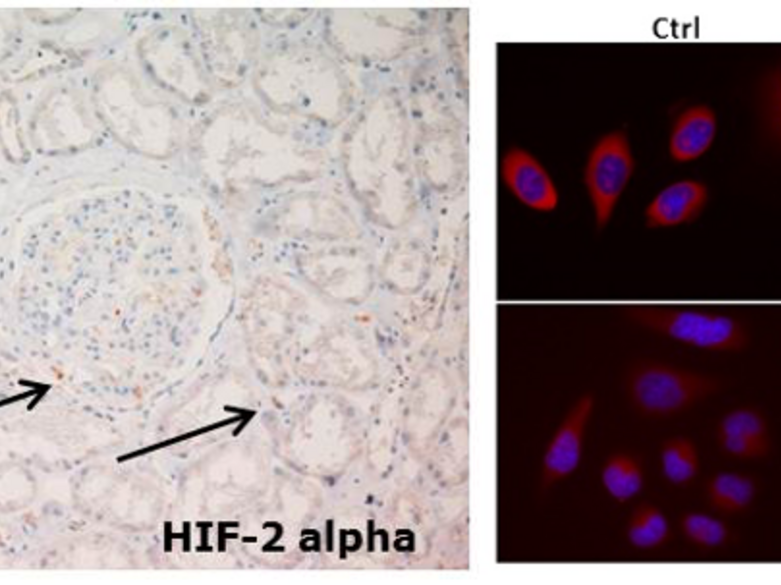
HIF-aktivierte, protektive Mechanismen können im Rahmen einer akuten Nierenschädigung positive Auswirkungen auf die tubuläre Funktion haben. Im Gegensatz hierzu werden durch die HIFs im Rahmen des VHL-assoziierten Nierenzellkarzinoms allerdings auch onkogene Prozesse angeschaltet, die zu einem Fortschreiten dieser Erkrankung führen können.
Unsere Forschung hat zum Ziel, zelltypspezifische Funktionen und epigenetische Charakteristika der HIF-Bindung zu identifizieren und dabei Mechanismen zu definieren, die die direkte HIF-DNA Interaktion beeinflussen. Zur Identifikation relevanter Bindungsstellen bedienen wir uns dabei der modernen Methodik zur Analyse der Protein-DNA-Interaktion gekoppelt mit Next-Generation Sequencing (ChIP-seq, FAIRE-seq, RNA-seq). Funktionell charakterisieren wir die DNA-Elemente in entsprechenden Zelllinien mithilfe neuester „Genome-Editing“ Technologie (CRISPR/Cas, TALEN). Zudem sind wir daran interessiert, die Interaktion von HIF-Bindung, Epigenetik und krankheitsassoziierten DNA-Polymorphismen (z.B. im Nierenzellkarzinom oder in der akuten bzw. chronischen Nierenschädigung) näher zu untersuchen.
Kooperationen
- Prof. Sir Peter Ratcliffe, The Francis Crick Institute, London und Ludwig Institute for Cancer Research, University of Oxford
- Prof. David Mole, Nuffield Department of Medicine, University of Oxford
- Prof. Günther Greiner, Lehrstuhl für Informatik 9, Friedrich-Alexander-Universität Erlangen-Nürnberg
- Prof. Arndt Hartmann, Dr. Christine Stöhr, Institut für Pathologie, Universitätsklinikum Erlangen
- SFB 1350, Universität Regensburg
Arbeitsgruppenleiter
Wissenschaftliche Mitarbeitende
Technische Mitarbeitende
Doktorand/-innen
Renè Krüger (Naturwissenschaften)
Johannes Weidt (Medizin)